Aunque los productos ferrosos todavía siguen siendo los metales más utilizados en la actualidad, el resto de metales, es decir, los metales no férreos, son cada día más imprescindibles y se emplean cada vez más en la industria para la fabricación de multitud de productos.
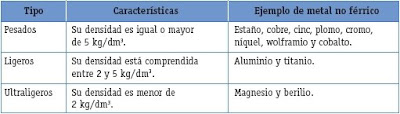
Los metales no ferrosos se pueden clasificar, según su peso específico, en pesados, ligeros y ultraligeros:
Los metales no ferrosos, ordenados de mayor a menor utilización, son: cobre (y sus aleaciones), aluminio, estaño, plomo, cinc, níquel, cromo, titanio y magnesio.
Dependiendo de sus características, estos materiales sustituyen con ventaja a los derivados del hierro en múltiples aplicaciones tecnológicas. Sin embargo, resultan más caro de obtener debido a diversas razones, entre las que destacan las siguientes:
• La baja concentración de algunos de estos metales es sus menas.
• La energía consumida en los procedimientos de obtención, y afino, ya que, la mayoría de los casos, se trata de procesos electrolíticos para los que se emplea energía eléctrica.
• La demanda reducida, que obliga a producirlos en pequeñas cantidades.
• El aluminio y sus aleaciones se caracterizan por la relativamente baja densidad( 2,7 g/cc), elevadas conductividades eléctricas y térmica y resistencia a la corrosión en algunos medios, incluyendo el atmosférico. A muchas de estas aleaciones se les puede dar forma diferente con facilidad debido a su alta ductilidad; esto es evidente en el aluminio puro que se puede convertir en papel y enrollar.

El aluminio tiene una estructura cúbica centrada en las caras y es dúctil incluso a temperatura ambiente. La principal limitación del aluminio es la baja temperatura de fusión 660ºC, que restringe su campo de aplicación.
La resistencia mecánica del aluminio se logra por acritud o por aleación; sin embargo ambos procesos disminuyen la resistencia a la corrosión. Los principales elementos de aleación son el cobre, magnesio, silicio, manganeso y zinc.
Algunas de las aplicaciones más comunes de las aleaciones de aluminio son: partes estructurales de los aviones, latas para bebidas refrescantes, partes de la carrocería de los autobuses y de los automóviles ( culatas, pistones, y colectores de escape)
Actualmente se presta mucha atención a las aleaciones de aluminio y de otros metales de baja densidad (Mg,Ti) como materiales utilizados en los transportes, debido al efecto de ahorro de combustible.
----------------------------------------------------------------------------------------
Se trata de un metal bastante escaso en la corteza terrestre. Afortunadamente, se suele encontrar concentrado en minas, aunque la riqueza suele ser bastante baja (del orden del 0,02%).El mineral de estaño más explotado es la casiterita(ver imágen inferior) , en el que este metal se encuentra en forma de óxido (SnO2).
Las características principales del estaño son las siguientes:
El estaño puro tiene un color muy brillante. A temperatura ambiente se oxida y pierde el brillo exterior.
• A temperatura ambiente es muy maleable y blando, y pueden obtenerse hojas de papel de estaño de algunas décimas de milímetro de espesor. Sin embargo, en caliente es frágil y quebradizo.
• Por debajo de –18 °C empieza a descomponerse y a convertirse en un polvo gris. A este proceso se le conoce como enfermedad o peste del estaño.
• Cuando se dobla se oye un crujido denominado grito del estaño.Las aleaciones principales de estaño son:
• Bronce. Es un aleación de cobre y estaño.(IMAGEN INFERIOR)
• Soldaduras blandas. Son aleaciones de plomo y estaño con proporciones de estaño entre el 25 y el 90 %.
• Aleaciones de bajo punto de fusión. Las más importantes son:
– Darcet (25 % Sn + 25 % Pb + 50 % Bi), que funde a los 97 °C.
– Cerrolow (8,3 % Sn + 22,6 % Pb + 44,7 % Bi + 5,3 % Cd + 19,1 % In), que funde a los 47 °C.
Una de las aplicaciones más importantes del estaño es la fabricación de hojalata (imagen inferior). Consiste en recubrir una chapa de acero con dos capas muy finas de estaño puro. El estaño protege al acero contra la oxidación.
El proceso de obtención del estaño es el siguiente (véase la imágen inferior):
• La casiterita se tritura (1) y muele (2) en molinos adecuados. Luego se introduce en una cuba con agua (3), en la que se agita. Por decantación, el mineral de estaño (que es más pesado) se va al fondo y se separa de la ganga.
• Posteriormente se introduce en un horno (4), donde se oxidan los posibles sulfuros de estaño que hay en el mineral y se transforman en óxidos.
• La mena de estaño, en forma de óxido, se introduce en un horno de reverbero (5), donde se produce la reducción (transformación de óxido de estaño a estaño), depositándose el estaño en la parte inferior y la escoria en la superior.
• Finalmente, para obtener un estaño con porcentaje del 99 %, es necesario someterlo a un proceso electrolítico (6).

VIDEO PROPIEDADES Y APLICACIONES DEL ESTAÑO
-------------------------------------------------------------------------
Los minerales de cobre más utilizados en la actualidad se encuentran en forma de cobre nativo, sulfuros (calcopirita y calcosina) y óxidos (malaquita y cuprita) (imágen inferior).
Las características del cobre son las siguientes:
• Es muy dúctil (se obtienen hilos muy finos) y maleables (pueden formarse láminas hasta de 0,02 mm de espesor).
• Posee una alta conductividad eléctrica y térmica.
Existen dos métodos de obtención del cobre: por vía seca y por vía húmeda.
• Proceso de obtención del cobre por vía seca.
Se utiliza cuando el contenido de cobre supera el 10 %. En caso contrario, será necesario un enriquecimiento o concentración. Es el proceso que más se emplea y es análogo al usado para el estaño. Las fases del proceso pueden verse en la imagen inferior.
a) El mineral de cobre (1) se introduce en la trituradora o machacadora (2). Luego se pasa por un molino de bolas (3) con objeto de pulverizarlo. Este molino consta de un cilindro con agujeros muy finos, por donde saldrá el mineral pulverizado, y unas bolas de acero que giran libremente cuando lo hace el cilindro.
b) Para separar la mena de la ganga, se introduce el mineral en polvo en un depósito lleno de agua (4) y se agita. El mineral, más pesado, se irá al fondo, mientras que la ganga flotará y se sacará por arriba.
c) El mineral concentrado se llevará a un horno (5), donde se oxidará parcialmente. El objetivo es oxidar el hierro presente, pero no el cobre. Actualmente se suele colocar en una cinta transportadora metálica que se mueve lentamente al mismo tiempo que se calienta la mena. De esta manera se consigue separar el hierro del cobre.
d) A continuación se introduce todo en un horno de reverbero (6), donde se funde. Se le añade fundente (sílice y cal) para que reaccione con el azufre y el óxido de hierro y forme la escoria. El cobre aquí obtenido tiene una pureza aproximada del 40 % y recibe el nombre de cobre bruto o cobre blíster. Si se quiere obtener un cobre de pureza superior al 99,9 % (9), es necesario un refinado electrolítico en la cuba (8).
• Proceso de obtención del cobre por vía húmeda.
Se emplea cuando el contenido en cobre del mineral es inferior al 10 %. El procedimiento consiste en triturar todo el mineral y añadirle ácido sulfúrico. Luego, mediante un proceso de electrólisis, se obtiene el cobre.
La adición de otros metales no ferrosos al cobre mejora sustancialmente sus propiedadesmecánicas y de resistencia a la oxidación, aunque empeora ligeramente su conductividadeléctrica y calorífica. Las aleaciones más usadas son: bronce, latón, cuproaluminio, alpaca y cuproníquel (véase en la imagen inferior).
VIDEO DEL COBRE
------------------------------------------------------------------------------
Además de los metales no ferrosos estudiados anteriormente, existen otros, entre los que cabe resaltar: cromo, níquel, wolframio o tungsteno y cobalto (ver imágen inferior).

--------------------------------------------------------------------------------------------
METALES NO FERROSOS LIGEROS
Se encuentra abundantemente en la naturaleza, ya que es uno de los componentes de casi todas las rocas de origen volcánico que contienen hierro.La extracción del titanio es un proceso complejo, lo que encarece extraordinariamente el producto final.
En la actualidad, los minerales de los que se obtiene el titanio son el rutilo(1ª imagen inferior) y la ilmenita(segunda imagen inferior).


El titanio posee las siguientes características fundamentales:
• Es un metal blanco plateado que resiste mejor la oxidación y la corrosión que el acero inoxidable.
• Las propiedades mecánicas son análogas, e incluso superiores, a las del acero, pero tiene la ventaja de que las conserva hasta los 400 °C.
En cuanto al proceso de obtención del titanio, en la actualidad se emplea casi exclusivamente el método Kroll, que consta de cloración, transformación y obtención:

Respecto a las aplicaciones del titanio, dada su baja densidad y sus altas prestaciones mecánicas, se emplea mayoritariamente en la fabricación de estructuras y elementos de máquinas en aeronáutica (aviones, cohetes, misiles, transbordadores espaciales, satélites de comunicaciones, etc.). Normalmente se suele emplear aleado con el 8 % de aluminio. Para mejorar las propiedades físicas, se le suele alear también con cromo, vanadio y molibdeno. Se emplea también en la fabricación de herramientas de corte (nitrato de titanio), en la construcción de aletas para turbinas (carburo de titanio), así como, en forma de óxido y pulverizado, para la fabricación de pinturas antioxidantes.